대학생의 성별, 스트레스, 불안 및 우울 정도에 따른 심박변이도 차이: Neurovisceral integration model에 기반하여
Differences in Heart Rate Variability Depending on Sex, Level of Stress, Anxiety, and Depression among College Students: on the Basis of Neurovisceral Integration Model
Article information
Abstract
Purpose: This descriptive study aimed to investigate heart rate variability (HRV) according to sex and to elucidate the influence of negative emotion such as levels of stress, anxiety and depression on HRV among Korean college students based on a neurovisceral integration model. Methods: A descriptive study design was used. Eighty-six healthy college students participated in the study. Resting HRV and standing HRV on orthostatic stimulation were measured for 5 minutes during 4-6 p.m. in the afternoon. Levels of stress, anxiety and depression were assessed using the Global assessment of recent stress, State-Trait Anxiety Inventory and Beck Depression Index, respectively. Results: Out of the 86 students, 47 (54.7%) were men and 39 (45.3%) were women. Root mean square of the differences between adjacent RR intervals (RMSSD) and normalized high frequency (nHF) on standing HRV were significantly lower in men than in women (p=.005, p=.019, respectively). Male gender (β=0.30, p=.013), higher level of stress (β=-0.36, p=.009) and lower level of depression (β=0.30, p=.044) exerted a significant influence on decreased nHF in the multiple regression analysis. Conclusion: We suggest that men are more vulnerable to having reduced vagal activity on HRV than women. Since male gender, higher level of stress and lower level of depression level influenced decreased vagal activity, strategies are needed to improve stress and depression rather than anxiety especially for men, which contribute to promoting HRV to prevent cardiac health diseases.
서 론
1. 연구의 필요성
스트레스나 불안, 우울과 같은 정서적 문제들은 종종 질병으로 인해 생기기도 하지만, 질병을 더욱 악화시키기도 한다[1]. 특히, 스트레스나 불안, 우울은 비교적 흔한 것으로 알려져 있는데, 이러한 정서적 문제는 청소년기에서 성인기로 넘어가는 초기 성인기의 대학생들에게 발생하기 쉽다. 이 시기에는 대인 관계나 사회적 관계가 확대되고 여러가지 심리적 갈등 상황을 맞닥뜨릴 수 있는데 비해서[2], 신경발달적인 측면에서는 충분히 성숙되지 않았기 때문에 스트 레스나 불안, 우울과 같은 정서적 증상을 흔히 경험한다. 한 연구에 따르면 한국인 대학생 중 우울과 불안을 경험하는 학생의 비율이 각각 약 41%, 36%인 것으로 조사된 바 있다[3]. 또한 이러한 한국 대학생의 우울이나 불안은 유럽 대학생의 6.3%가 우울을 경험하며[4], 미국인 학생의 17-21%가 불안을 경험하는 것[5]과 비교했을 때, 다소 높은 수치를 보였다.
대학생들의 스트레스나 불안, 우울 같은 정서적 증상들은 신체적 건강과 관련될 수 있는데, 특히 자율신경계의 변화를 일으킬 수 있다. 자율신경계의 상태를 나타내는 지표로 심박변이도(heart rate variability, HRV)를 흔히 이용한다. 심박변이도는 심박동 사이의 간격을 측정하여 심장주기의 시간적 변동을 정량화하는 방법으로, 비침습적으로 측정할 수 있기 때문에 스트레스 중재 후 효과 평가를 위해 간호학 연구에서도 종종 측정되기도 한다. Thayer and Lane (2009)의 Neurovisceral integration model에 의하면 뇌의 전전두엽 피질(prefrontal cortex)과 편도체(amygdala)는 위협을 인지하고 감정 및 정서와 관련된 정보를 처리할 뿐만 아니라, 시상하부(hypothalamus)와 긴밀하게 연계되어 부교감 신경을 조절함으로써 자율신경계 기능에 영향을 주는 것으로 설명하고 있으며, 스트레스나 부정적인 정서 자극들이 있는 경우에는 편도체의 활성화로 인해 부교감 신경이 억제되어 자율신경계 조절에 문제가 생길 수 있다고 하였다[6]. 선행 간호학 연구에서도 스트레스 반응시나 불안이 있는 경우에 교감신경계의 활성도가 증가하는 것으로 보고된 바 있다[7]. 그러나 우울과 연관된 자율신경계의 변화에 대해서는 국내에서는 많이 연구되지 않았다. 최근 해외 연구에서는 우울과 심박변이도에 대한 연구가 보고되고 있으나 연구 결과가 상반되게 나타나고 있다. 대만의 여대생을 대상으로 한 연구에서 불안과 우울이 있는 학생이 심박변이도가 전반적으로 증가되어 있었다고 하였고[8], 다른 연구에서는 불안이나 우울이 있는 경우 심박변이도가 저하된다고 하였다[9]. 따라서 스트레스나 불안뿐만 아니라 우울까지 포함하여 정서적 증상들에 따른 심박변이도의 변화에 대한 통합적인 분석이 필요하다.
또한 정서적 증상과 심박변이도의 관련성은 성별에 따라 다를 수 있음이 제시된 바 있다[10]. 그럼에도 불구하고 한국인을 대상으로 측정한 심박변이도의 특성이나 정서적 증상들과의 관련성을 심도있게 분석한 연구는 드물다. 특히 최근의 연구에 따르면 성별에 따라 정서의 인지나 이에 따른 신체적 반응이 나타나는 특성이 다르고[11], 심박변이도 자체도 연령이나 성별에 따라 차이가 있는 것으로 보고된 바 있다[12]. 심박변이도의 변화는 염증성 지표들의 증가[13]나 심질환 위험[14]과 관련될 수 있음을 고려할 때, 한국 대학생의 심박변이도를 측정하고, 성별 및 정서적 증상에 따른 심박변이도의 변화를 분석해 볼 필요가 있다.
따라서 본 연구는 대학생들의 심박변이도를 측정하여 성별에 따른 자율신경계의 기능을 파악하고, 스트레스, 불안 및 우울 수준이 심박변이도에 미치는 영향을 규명해 보고자 한다.
2. 연구 목적
본 연구의 목적은 대학생들의 심박변이도를 측정하여 자율신경계 기능을 파악하고, 성별에 따른 자율신경계 기능의 차이를 알아보고, Neurovisceral integration model에 근거하여 이들의 스트레스, 불안 및 우울 수준이 심박변이도에 미치는 영향을 분석하는 것으로 구체적인 목적은 다음과 같다.
대학생들의 심박변이도를 측정하여 성별에 따른 자율신경계 기능을 파악한다.
대학생들의 성별과 스트레스, 불안 및 우울 정도가 심박변이도에 미치는 영향을 규명한다.
연구 방법
1. 연구 설계
본 연구는 대학생의 심박변이도를 측정하여 성별에 따른 자율신경계 기능을 파악하고, 이들의 스트레스, 불안 및 우울 정도가 심박변이도에 미치는 영향을 분석하기 위한 서술적 조사 연구이다.
2. 연구 대상
연구 대상자는 일 지역에 위치한 대학에 재학 중인 건강한 대학생 86명으로, 연구 참여에 동의한 대상자들이다. 단, 고혈압, 부정맥, 협심증, 심근경색을 포함한 특별한 건강문제가 있거나, 현재 약물을 복용 중이거나, 교대근무 등으로 수면-각성 주기가 불규칙한 대상자는 제외하였다. 연구 대상자들은 정확한 심박변이도 측정을 위해 측정 24시간 전부터는 카페인, 니코틴, 알코올 섭취를 제한하였다.
연구 대상자수는 G-power 3.1.9를 이용하여 산정하였다[15]. 심박변이도에 영향을 미치는 요인을 파악하기 위해 선형회귀분석(linear multiple regression)을 기준으로 유의수준 .05, 검정력 0.80, 예측변수 6개로 설정하고, 선행연구[16]에서 제시된 R2을 사용하여 계산한 효과크기 0.18로 하였을 때, 필요한 최소 대상자 수는 83명이었다. 본 연구에서는 총 86명의 대상자를 조사하였다.
3. 연구 도구
1) 대상자의 인구학적 특성
대상자의 나이, 성별, 신장, 체중, 경제적 상태, 음주, 흡연상태 등의 정보는 설문지를 이용하여 수집하였다.
2) 심박변이도 측정
심박변이도는 Heart Rhythm Scanner 3.0 (Biocom Technologies, Poulsbo, USA)을 이용하여 측정하였다[17]. 연구대상자의 좌우 손목 내측 부위에 각각 전극을 부착하고 5분간 누워 안정을 취하게 한 후, 안정시의 심박변이도를 5분간 측정하였다(안정 시 심박변이도, Resting HRV). Neurovisceral integration model에 의하면 정서적인 문제가 있는 경우 발생하는 부교감신경 활성도의 저하가 중요하므로, 본 연구에서는 교감신경을 자극한 후의 부교감신경 활성도의 저하 정도를 확인하기 위해 대상자에게 교감신경 자극 프로토콜을 적용한 후 심박변이도를 측정하였다. 교감신경 자극 프로토콜[18]에 따라 안정상태로 누워 있던 대상자를 앉은 자세로 변경시키고(orthostatic stimulation), 5분간 기다렸다가 5분간 심박변이도를 측정하였다(직립시 심박변이도, standing HRV). 심박변이도의 일중 리듬을 고려하여 모든 대상자의 심박변이도를 일정한 시간대에(오후 4-6시 사이)에 측정하였다. 측정된 심박변이도 신호로부터 시간 영역의 지표인 심박표준편차(standard deviation of normal NN intervals, SDNN), RMSSD (Root mean square of the differences between adjacent RR intervals), 주파수 영역의 지표인 표준 저주파 전력(Low frequency, LF), 표준 고주파 전력(High frequency, HF), 고주파와 저주파의 비율(LF/HF ratio)을 추출하였다. 심박변이도 각 지표의 의미는 다음과 같다[19].
(1) 심박표준편차(SDNN)
심전도상 RR 간격의 표준편차를 의미하며, 기록된 시간동안 심박동의 변화를 의미한다. 심혈관계의 안정도와 심장 리듬의 반응성을 나타내는 지표로 해석할 수 있으며, SDNN이 감소한 경우에는 심박변동이 단조롭고 환경의 변화에 대해 자율신경계의 적절한 대응이 잘 이루어지지 못함을 의미한다.
(2) 연속되는 NN 간격 차의 제곱 평균에 대한 제곱 근(RMSSD)
인접한 RR 간격의 차이 제곱합의 평균값에 square root를 한 값으로, 고주파 전력의 변화를 반영하므로 부교감 신경의 활성을 나타내는 비교적 안정적인 지표이다. 수치가 높을수록 부교감 신경의 활성도가 높음을 의미한다.
(3) 표준 저주파 전력(normalized Low frequency, nLF)
심박변이도 분석시 0.04-0.15 Hz 영역대의 저주파 전력의 면적 값으로, 교감신경계 활성을 나타내는 지표이다. 값이 클수록 교감신경계의 활성도가 높음을 의미한다. 본 연구에서는 일관된 성질을 갖지 못하는 초저주파(very low frequency, VLF)와 전체적인 자율신경계의 조절 능력을 의미하는 total power (TP)를 고려하여 표준화한 표준 저주파 전력을 산출하였다.
(4) 표준 고주파 전력(normalized High frequency, nHF)
심박변이도 분석시 0.15-0.4 Hz 영역대의 고주파 전력의 면적 값으로, 부교감신경계 활성을 나타내는 지표이며, 값이 클수록 부교감신경계의 활성도가 높음을 의미한다. 본 연구에서는 일관된 성질을 갖지 못하는 초저주파(VLF)와 전체적인 자율신경계의 조절 능력을 의미하는 TP를 고려하여 표준화한 표준 고주파 전력을 산출하였다.
(5) 고주파와 저주파의 비율(LF/HF ratio)
고주파와 저주파의 비율로서, 교감신경계와 부교감신경계의 전체적인 균형정도를 나타내는 지표이다. 교감신경계의 활성도가 높을수록, 부교감신경계 활성도가 낮을수록 수치가 증가한다.
3) 스트레스, 불안 및 우울 수준
대상자들의 스트레스 정도를 평가하기 위해 한국어판 전반적인 스트레스 평가 도구(The Korean version of Global Assessment of Recent Stress, GARS-K) [20]를 이용하였다. 이 도구는 지난 일주일간의 스트레스 정도를 측정하는 도구로, 스트레스 인지 반응을 측정하는 8문항으로 구성되어 있다. 각 문항은 0-9점의 likert 척도로 답하게 되어 있으며, 총점은 72점으로 점수가 높을수록 스트레스 정도가 높음을 의미한다. 선행 연구에서 도구의 신뢰도는 Cronbach’s alpha .86이었고[21], 본 연구에서 Cronbach’s alpha는 .78이었다.
불안 수준은 Spielberger (1972)가 개발한 상태-특성 불안 척도(State-Trait Anxiety Inventory, STAI) [22]를 사용하여 측정하였다. 이 도구는 상태-특성 불안을 측정하는 문항 36개로 구성되어 있으며 각 문항은 1-4점까지의 척도로 답할 수 있다. 총 144점 중 점수가 높을수록 불안 정도가 심한 것을 뜻한다. 선행 연구에서 도구의 신뢰도는 Cronbach’s alpha .90으로 보고되었고[23], 본 연구에서 Cronbach’s alpha는 .95이었다.
우울 수준을 평가하기 위해서 Beck Depression Inventory (BDI)[24]를 이용하였다. 이 도구는 우울의 인지적, 신체적, 정서적 요인의 측면에 관한 21개의 문항으로 구성되어 있으며, 각 문항은 0-3점의 척도로 답할 수 있고, 총점은 63점이다. 점수가 높을수록 우울 정도 가 심함을 의미한다. 선행 연구에서 도구의 신뢰도는 Cronbach’s alpha .87이었고[25], 본 연구에서 Cronbach’s alpha는 .81이었다.
4. 자료 수집
연구 대상자는 I 지역 일개 대학의 교내 온라인 게시판의 공고를 통해 모집하였으며, 2017년 5월-2018년 12월의 기간 동안 자료수집을 진행하였다. 공고를 보고 참여의사를 밝힌 대상자들과 전화로 방문 일시를 정하고 방문 전 유의사항을 설명한 후, 연구실로 방문하도록 안내하였다. 대상자가 연구실을 방문했을 때, 연구 보조원이 대상자에게 연구에 대한 설명을 하였으며, 대상자가 서면 동의서에 서명한 후 자발적으로 연구에 참여하였다. 먼저 대상자에게 설문지를 배부하여 인구학적 정보와 스트레스, 불안, 우울 수준에 대해 답하도록 하였다. 이후 연구실에 마련되어 있는 침대에 누워 약 20-30분간 심박변이도를 측정하였다. 심박변이도의 일중 변동을 고려하여 대상자는 일괄적으로 오후 4-6시 사이에 방문하도록 하여 심박변이도 측정 및 자료수집을 진행하였다. 자료 수집을 완료한 대상자에게는 소정의 사례비를 지급하였다.
자료수집은 3인의 연구 보조원이 시행하였다. 측정자간 신뢰도를 확보하기 위해 연구 시작 전에 1시간에 걸쳐 3인의 연구보조원에게 자료수집 방법 및 절차, 심박변이도에 대해 교육하였다. 또한 연구보조원 3인이 함께 3명의 대상자에게 심박변이도 측정 및 자료 수집을 진행한 후, 연구자와 논의과정을 통해 심박변이도 측정 프로토콜 및 자료 수집 방법상의 세부사항을 조율하였다.
5. 자료 분석
수집된 자료는 IBM SPSS Statistics 25 for Windows (IBM, Armonk, USA) 통계프로그램을 이용하여 분석하였다. 대상자의 일반적 특성은 기술통계방법을 이용하였다. 연구 변수들의 정규 분포를 확인하기 위해 Shapiro-Wilk 검정을 이용하였으며, 검정 결과 정규분포를 보이지 않았던 지표들은 비모수 검정 방법 및 로그변환을 이용하여 분석하였다. 성별에 따른 심박변이도는 t-test 및 Mann-Whitney 검정을 이용하였으며, 인구학적 특성 및 정서적 증상이 심박변이도에 미치는 영향을 분석하기 위하여 다변량 선형회귀분석(multiple linear regression)을 이용하여 분석하였다. 정규분포를 보이지 않았던 변수인 나이, 불안, 우울은 로그변환을 하여 다변량 선형회귀분석에 투입하여 분석하였다. 모든 통계 분석의 유의수준은 p<.05으로 하였다.
6. 윤리적 고려
본 연구는 연구 대상자 보호를 위하여 I 대학교 기관생명윤리위원회의 승인을 받은 후 시행하였다(승인번호: 170228-1A). 연구 참여시 대상자에게 연구의 목적 및 대상자의 익명성과 비밀보장에 대한 내용을 설명하고, 설문 작성 중에도 연구 참여를 중단하기 원하는 경우 언제든지 철회할 수 있음을 설명하였으며, 서면 동의를 한 자발적인 의사를 가진 대상자에 한하여 연구에 참여하였다.
연구 결과
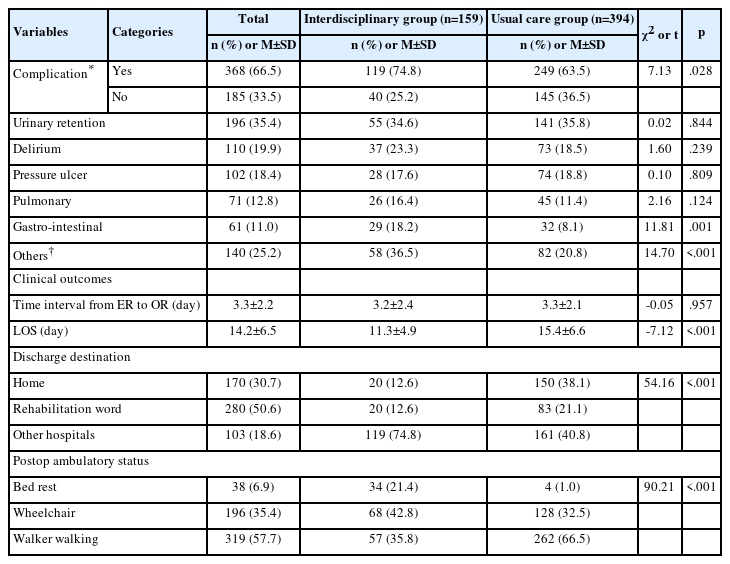
1. 대상자의 일반적 특성
총 86명의 자료가 결과분석에 이용되었다. 86명 중 47명(54.65%)이 남성이었고, 39명(45.34%)이 여성이었다(Table 1). 나이는 남성이 평균 22.51세로 여성의 21.33세보다 유의하게 많았다(p=.004). 체중 또한 남성이 69.31 kg로 여성의 평균 56.05 kg보다 유의하게 높았고(p<.001), 신장도 남성이 173.23 cm, 여성이 162.11 cm으로 남성이 더 큰 것으로 나타나(p<.001) 성별 간의 신체적인 차이를 확인할 수 있었다. 이외의 월 수입이나, 흡연 및 음주 정도는 남녀간에 유의한 차이가 없었다.
2. 성별에 따른 스트레스, 불안, 우울 수준과 심박변이도
전체 86명의 평균 스트레스 점수는 26.12점이었고, 평균 불안 점수는 88.85점이었으며, 스트레스와 불안은 남녀 간의 차이가 없었다(Table 2). 우울 수준은 전체 평균 점수가 7.94점이었고, 남성의 경우 6.70점, 여성의 경우 9.44점으로 여성에서 다소 높았으나 성별에 따른 유의한 차이는 없었다.
안정시 심박변이도는 남성이 여성에 비해 부교감신경 활성도를 나타내는 시간 영역 지표인 RMSSD와(U=481.00, p<.001) 주파수 영역 지표인 nHF가(t=-3.24, p=.002) 모두 유의하게 낮았고, 교감신경의 활성도를 나타내는 nLF가 유의하게 높았다(t=3.23, p=.002). 부교감신경과 교감신경의 균형도를 나타내는 LF/HF는 역시 남성에서 유의하게 높았다(U=556.50, p=.031).
직립시 심박변이도는 안정시 심박변이도와 유사한 결과를 보였다. 남성이 여성에 비해 부교감신경 활성도를 나타내는 RMSSD (U=559.50, p=.005,)와 nHF(t=-2.34, p=.019)가 유의하게 낮았고, 교감신경의 활성도를 나타내는 nLF가 유의하게 높았다(t=2.47, p=.016). 또한 부교감신경 활성도 대비 교감신경활성도를 나타내는 LF/HF가 남성에서 유의하게 높았다(U=561.00, p=.005).
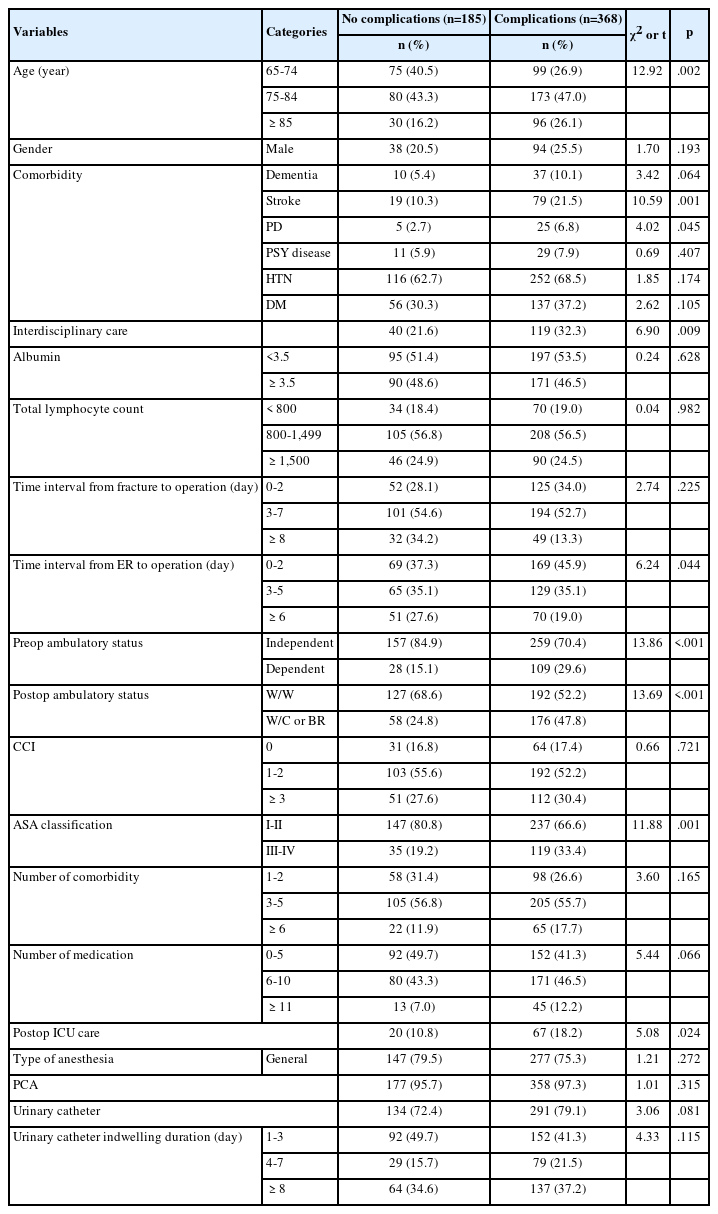
3. 심박변이도에 영향을 미치는 요인
직립시에 부교감신경 활성도를 나타내는 nHF와 유의한 상관관계가 있었던 일반적 특성 변수인 성별과 비만도(BMI), 정서적 증상 변수인 스트레스, 불안 및 우울 수준을 독립변수로 하여 다변량 선형회귀 분석을 시행하였다(Table 3). 잔차 분석 결과, 회귀모형은 모형의 선형성, 오차의 등분산성과 정규성을 만족하였다. Tolerance는 .41-.84로 .10 이상이었고, VIF는 1.19-2.43으로 10 이하이므로 다중공선성의 문제는 없었다. 또한 Durbin-Watson 통계량은 2.08로 자기 상관성을 보이지 않았다. 회귀모형은 유의하였고(F=3.01, p=.011), 20%의 설명력을 보였다. 직립시 부교감신경 활성도는 남성인 경우(β=0.30, p=.013), 스트레스가 높을수록(β=-0.36, p=.009), 우울 정도가 경할수록(β=0.30, p=.044) 유의하게 낮았다.
직립시에 교감신경 활성도를 나타내는 nLF와 유의한 상관관계가 있었던 일반적 특성 변수인 성별과 비만도, 정서적 증상 변수인 스트레스, 불안, 우울 수준을 독립변수로 하여 다변량 선형회귀 분석을 시행한 결과, 회귀모형은 모형의 선형성, 오차의 등분산성과 정규성을 만족하였다. Tolerance는 .41-.84, VIF는 1.19-2.43으로 다중공선성의 문제는 없었고, Durbin-Watson 통계량은 2.07로 자기상관성이 없는 것을 확인하였다. 회귀모형은 유의하였으며(F=3.14, p=.009), 설명력은 21%를 보였다. 직립시 교감신경 활성도는 남성인 경우(β=-0.31, p=.010), 스트레스가 높을수록(β=0.36, p=.007), 우울 정도가 낮을수록(β=-0.30, p=.043) 유의하게 높았다.
논 의
본 연구는 초기 성인기 대학생들의 심박변이도를 조사하고 남녀 차이를 파악하며, Neurovisceral integration model에 기반하여 스트레스와 불안 및 우울 수준이 심박변이도에 미치는 영향을 조사하기 위해 시행되었다.
심박변이도는 안정시 심장반응성을 나타내는 SDNN이 평균 51.1 ms, 부교감신경 활성도를 나타내는 RMSSD가 45.9로 나타나 20대 성인의 일반적인 수치 범위 안에 있음을 확인할 수 있었다[26]. 그러나 Kuang 등[27]은 평균 나이대가 20대인 대상자들에서 26-36 정도의 RMSSD를 보고하여 본 연구 대상자보다 낮았는데, 이는 RMSSD의 일중리듬과 관련되었을 수 있다. RMSSD는 호흡이나 신체의 움직임에 영향을 덜 받는 안정적인 지표이고[28] 비교적 일정한 일중 리듬을 보이는데, 오후 12-1시경 최저값을 보인다[29]. Kuang 등[27]은 오전 9시-오후 6시 사이에 RMSSD를 측정한 반면 본 연구에서는 오후 4-6시 사이에 측정을 하였기 때문에 Kuang 등[27]의 연구에서 측정한 여성들의 RMDSSD보다 높게 측정되었을 수 있다. 또한 본 연구에서 LF/HF 비율은 1.8 au로, 선행 연구[30]에서 유사한 연령대의 간호학과 학생에서 측정한 LF/HF 비율인 약 0.9 au보다 약 2배 높았다. 이는 남녀의 비율 차이와 관련될 수 있다. 선행 연구에서는 거의 대부분이 여성(약 90%)으로 구성된 간호학과 학생들이었으나, 본 연구에서는 남성이 조금 더 많았다. 본 연구에서 성별에 따른 LF/HF 비율은 남성에서 유의하게 높았는데, 이러한 특성을 가진 남성이 본 연구 대상자에 많았기 때문에 선행 연구결과의 수치와 차이를 보였던 것으로 생각된다. 실제로 본 연구 대상자와 남녀 비율이 유사했던 최창진 등[31]의 연구에서는 LF/HF 비율이 본 연구와 유사하게 보고된 바 있다.
성별에 따른 심박변이도를 좀 더 자세히 보면, 안정시 심박변이도에서 남성이 RMSSD가 저하되어 있었고, 특히 교감신경 활성을 촉진시킨 후에 측정했던 직립시 심박변이도에서는 부교감신경 활성도를 나타내는 RMSSD, nHF가 모두 여성에 비해 유의하게 감소되어 있었다. 이는 선행 연구에서 나타난 남녀 차이와 유사하다[32]. 남성에서 나타나는 이러한 부교감신경 활성도의 저하는 부교감신경을 활성화하고 교감신경을 약화하는 기능이 있는 에스트로겐의 상대적 부족[33]이나 남성에서만 보이는 신경성장 유전자(nerve growth factor gene)의 부교감신경 저하 기능[34]과 관련이 있을 것으로 추측할 수 있다.
부교감 신경활성도를 비롯한 전반적인 심박변이도 지표들의 저하는 심혈관 질환[35]이나 인지기능 저하[36]와 관련이 있는 것으로 알려져 있다. 본 연구에서 유의하지는 않았지만 남성에서 교감신경 활성도를 제외한 다른 심박변이도 지표들(심장 반응을 나타내는 SDNN 지표나 부교감신경 활성도를 나타내는 RMSSD나 nHF 등)이 전반적으로 여성보다 저하되어 있었고, 회귀분석 결과에서도 남성들이 유의하게 부교감신경 활성도(nHF)가 낮고, 교감신경 활성도(nLF)가 높았다. 그러나 이들의 스트레스나 불안, 우울의 정도는 전반적으로 여성보다 낮았는데, 이는 선행 연구에서 불안과 같은 정서적 증상이 있는 경우 심박변이도가 감소된다고 보고한 것과 비교했을 때, 상반된 결과이다[37]. 본 연구에서 측정된 심박변이도를 볼 때, 남성들이 경한 정도의 정서적 증상에도 심박변이도의 변화가 생길 수 있음을 나타내는 것으로 추측할 수 있겠고, 또한 남성들이 스트레스나 불안, 우울과 같은 정서적 증상을 덜 표현했을 가능성도 배제할 수 없겠다. Ruigrok 등[38]은 남성은 부정적인 정서에 ‘반응’하는 뇌 부위인 편도체(amygdala)의 부피가 여성에 비해 크고, 여성은 부정적인 정서를 ‘조절’하는 뇌 부위인 전두엽 부위(frontal brain structure)의 크기가 상대적으로 크다고 하였다. 이와 함께 Neurovisceral integration model을 적용하여 본 연구 결과를 설명하면, 남성은 경한 정도의 정서적 문제에도 편도체가 더 활성화되기 쉽고, 이는 부교감신경 억제를 비롯한 심박변이도의 저하와 연결되는 것으로 보이며, 반대로 여성은 전두엽 부위가 우세하게 활성화되면서 부정적인 정서를 조절하여 심박변이도의 저하를 덜 보이는 것으 로 설명할 수 있겠다. Lischke 등[39] 역시 남성에서 정서 ‘조절’ 능력에 따라 심박변이도가 유의한 차이를 보였다고 하였으며, 따라서 본 연구에서 남성의 부교감신경 활성도를 비롯한 전반적인 심박변이도 지표들이 저하된 것은 이들이 부정적 정서를 조절할 수 있는 능력이 떨어져 있는 측면이 있었음을 시사한다. 남성 대학생들의 정서의 조절이나 이와 관련된 자율신경 조절 능력이 여성에 비해 취약한 것은 중장년기의 심질환 위험으로 이어질 수 있으므로[14], 남성의 정서적 증상이나 자율신경계 조절 기능에 대한 관심이 더 필요할 것으로 생각된다. 또한 추후 연구에서는 대상자들의 부정적 정서 조절 능력과 심박변이도에 대한 탐색이 필요할 것으로 보인다.
회귀분석 결과, 스트레스가 높을수록 부교감신경 활성도가 낮고, 교감신경 활성도가 높았는데, 이는 스트레스 상황에서는 부교감신경 활성도의 감소가 나타나며 이로 인해 교감신경 활성도가 증가한다는 선행연구 결과[40]와 일치한다. 그러나 불안은 심박변이도에 유의한 영향을 주지 못했으며, 특히 우울의 경우에는 오히려 우울 정도가 심할수록 부교감신경 활성도가 높고 교감신경 활성도가 낮았고 우울 수준의 이러한 영향력은 스트레스의 영향력과 유사하거나 약간 낮은 결과를 보였다. 이러한 결과는 우울과 심박변이도 관련 연구에서 우울이 있는 경우 부교감신경 활성도를 포함한 전반적인 심박변이도 지표가 저하되어 있었다는 결과[41]와 상이하였다. 이는 본 연구 대상자들의 우울 수준이 병적으로 높은 수준이 아니었기 때문으로 생각된다. Segerstrom 등[42]의 Pause and plan model에 의하면 자율신경계의 부교감신경 활성은 정서적 증상에 의해 영향을 받기도 하지만, 반대로 적절한 사회적 기능을 하도록 유도하기도 하는 상호적인 관련이 있다고 하였다. 본 연구 대상자들은 병적인 우울증 환자가 아닌 정상적인 생활을 하면서 비교적 양호한 자율신경계 조절 기능을 가진 건강한 대학생들이었고, 이들은 우울감이 증가하면 자율신경계의 부교감신경 활성도가 오히려 증가하여 사회적 상호작용이나 기능을 적절하게 유지하려는 행동으로 연결되는 기전으로 해석할 수 있겠다. 몇몇 선행 연구에서도 임상적이지 않은 수준의 우울을 가진 대상자들에서는 우울 수준이 높을수록 교감신경 활성도가 저하되어 있었다거나[43], 우울 수준을 어느 정도 극복한 대상자들이 부교감신경 활성도가 증가해 있었다고 하여[44], 본 연구와 유사한 결과를 보고하였다. 그러나 이는 대상자들의 사회적 기능 정도까지 조사하는 추후 연구를 통해 재확인할 필요가 있다.
본 연구의 제한점은 첫째, 대상자의 수가 많지 않아 남녀별로 정서적 증상이 심박변이도에 어떻게 다른 영향을 미치는지 다변량 분석을 시행하지 못했던 점이다. 본 연구에서 성별이 심박변이도에 중요한 영향을 미치는 것을 확인한 만큼 추후에 더 많은 대상자들에서 이에 대한 깊이있는 분석이 이루어져야 할 것이다. 두번째로는 심박변이도의 측정이 5분간 1회로 짧았었던 점이다. 그러나 5분간 측정한 심박변이도는 24시간 측정한 심박변이도와 비교했을 때 안정적인 것으로 보고되고 있으므로[45], 본 연구에서 비교적 일관적인 시간대에 심박변이도를 측정한 점은 이러한 제한점을 어느 정도 보완할 수 있을 것으로 생각한다. 마지막으로, 본 연구 대상자들의 우울감이 전반적으로 높지 않았던 점이다. 우울증 환자들을 대상으로 한 연구나 경한 우울감 및 심박변이도와 함께 정서 조절 능력이나 사회적 기능까지 조사하는 연구가 추후에 진행된다면 우울과 심박변이도 간의 관련성을 더 심도있게 분석할 수 있을 것으로 보인다.
결 론
본 연구 결과, 여성에 비해 남성의 심박변이도 지표들이 전반적으로 유의하게 저하되어 있는 양상을 보였고, 이러한 성별에 따른 심박변이도의 차이는 회귀분석 결과에서도 남성에서 부교감신경 활성도가 유의하게 저하되어 있는 것으로 나타났다. 또한 스트레스, 불안 및 우울은 각각 다른 양상으로 심박변이도에 영향을 미쳤다. 다시 말해, 우울이 높을수록 유의하게 부교감신경 활성도가 증가하고 교감신경 활성도가 감소하였고, 스트레스와 불안은 반대의 경향을 보였으나 불안의 영향력은 유의하지 않았다.
본 연구의 의의는 Neurovisceral integration model에 기반하여 한국 초기 성인기 대학생들에서 특히 남성의 경우 부교감신경 활성도를 비롯한 전반적인 심박변이도가 취약함을 확인하고, 흔히 동시에 가지고 있는 정서적 증상인 스트레스, 불안 및 우울이 심박변이도에 미치는 영향력을 통합적으로 분석하여 심박변이도에 영향을 주는 요인으로 스트레스와 우울의 유의성을 설명하였다는 점이다. 이는 간호학적 측면에서 주요 간호 문제로 연구되는 스트레스, 불안이나 우울이 자율신경계 및 심장 기능에 어떻게 영향을 미치는지에 대한 이론적 근거로 활용될 수 있을 것이다. 또한 임상적 측면에서 볼 때, 부교감 신경 활성도의 저하는 심혈관질환과도 연관되므로 특히 남성 대학생들에서 정서적 증상을 조절함으로써 심박변이도를 개선시킬 수 있는 중재를 제공하는 것이 필요하다. 또한 추후 연구에서 이들의 부정적 정서 조절 능력이나 사회적 기능 정도까지 조사할 필요가 있으며, 심혈관 질환 위험이 있거나 관련 질환을 가지고 있는 대상자들에서 스트레스나 불안 및 우울과 심박변이도의 관련성을 조사할 필요가 있다.
CONFLICT OF INTEREST
The author declared no conflict of interest.
AUTHORSHIP
MHS contributed to the conception and design of this study, performed the statistical analysis and interpretation, drafted and critically revised the manuscript, and approved the final manuscript.