노인요양병원에 입원한 경도인지장애 노인의 휴식-활동 일주기 리듬에 관한 탐색적 연구: 타액 알파 아밀라제와의 관련성을 중심으로
Rest-activity circadian rhythm in hospitalized older adults with mild cognitive impairment in Korea and its relationship with salivary alpha amylase: an exploratory study
Article information
Trans Abstract
Purpose
This study aimed to evaluate the rest-activity circadian rhythm (RAR) using data obtained from wearable actigraph devices in hospitalized older adults with mild cognitive impairment (MCI), and to investigate its relationship with salivary alpha amylase (sAA).
Methods
This secondary data analysis used data from the Hospitalized Older Adults’ Cognition and Physical Activity Study. Actigraph data for 3-4 days were analyzed for RAR. RAR indices such as interdaily stability (IS), intradaily variability (IV), activity level during the most active 10-hour period and during the most least active 5-hour period, and relative amplitude (RA) were calculated. Data on sAA collected in the morning and general characteristics, including body mass index (BMI), were analyzed.
Results
Data from 92 hospitalized older adults with MCI were analyzed. The IS, IV, RA were 0.23, 0.73, 0.88, respectively. The average level of sAA was 77.02 U/mL, and a higher level of sAA was significantly associated with better IS and RA in the regression analysis, while age, BMI, and cognitive level were not. BMI showed positive correlations with IS and RA.
Conclusion
RAR in the hospitalized older adults with MCI was attenuated, showing especially low IS, which implies they failed to maintain regular and repetitive 24-hour RAR. Increased sAA and BMI were associated with robust RAR. Nurses need to pay attention to maintain robust RAR in hospitalized older adults with MCI, and strategies should be developed to improve their RAR.
서론
1. 연구의 필요성
노인은 노화에 따른 수면 양상의 변화를 경험하게 되고, 이에 따라 신체의 일주기 리듬(rest-activity circadian rhythm)에도 변화를 겪게 된다[1]. 특히 치매로 이환되기 쉬운 경도인지장애가 있는 노인들은 입면 후 각성시간(wake after sleep onset) 및 입면시간(sleep latency)이 늘어나면서 더 심각한 수면장애를 보이는 것으로 알려져 있는데[2,3], 이러한 수면양상의 변화는 휴식-활동 행위 양상인 휴식-활동 일주기 리듬에도 영향을 미친다[4].
휴식-활동 일주기 리듬은 24시간의 주기로 휴식-활동의 주기가 규칙적으로 변화하는 것을 말한다. 일상수행 능력을 반영하는 활동리듬과 수면을 반영하는 휴식리듬은 서로 밀접하게 연관되어 있기 때문에 노년기의 건강에 중요한 영향을 미칠 수 있다. 실제로 치매가 있는 시설 입소 노인에게 휴식-활동 일주기 리듬이 교란되어 있있고[5], 휴식-활동 일주기 리듬의 교란은 인지기능 악화[6] 및 낙상[7]과도 연관되는 것으로 보고된 바 있다. 간호사들은 24시간 내내 연속성을 가지고 입원 노인 환자들의 건강을 돌보는 의료인으로서, 치료기간 동안 이들의 건강한 입원생활을 도모하여, 오히려 입원으로 인해 초래될 수 있는 노인의 건강 문제를 예방하고 이들이 지역사회로 복귀할 수 있도록 관심을 기울여야 한다. 그러므로 노인들의 휴식-활동 일주기 리듬을 확인하고 관련된 건강요인들을 조사할 필요가 있다.
타액 알파 아밀라제(salivary alpha amylase)는 침샘에서 분비되는 효소로, 침샘들은 자율신경계에 의해 조절된다. 침샘 자체는 부교감신경에 의해 자극되어 침 분비가 증가하나, 침샘의 알파 아밀라제 효소의 분비는 교감신경에 의해 분비가 증가하기 때문에[8], 알파 아밀라제는 교감신경의 활성을 반영한다. 뿐만 아니라 알파 아밀라제는 스트레스에 반응하여 증가하며[9] 경도인지장애 노인에서도 증가되어 있는 것으로 알려져 있다[10]. 자율신경계의 활성, 특히 교감신경계의 활성 증가나 알파 아밀라제의 증가는 수면의 변화와 관련이 되어 있으므로[11,12], 알파 아밀라제의 분비는 수면 뿐만 아니라 휴식-활동 행위 양상에도 변화를 주어 휴식-활동 일주기 리듬에 영향을 줄 수 있을 것으로 생각되며, 이는 입원 환경에서 스트레스를 받고 있는 경도인지장애 노인에서 두드러지게 나타날 수 있다. 선행 연구에 의하면 자율신경계 및 시상하부-뇌하수체-부신축과 같은 스트레스 시스템과 인체의 일중 리듬 간에는 밀접한 관련성이 제기되고 있다[13]. 뿐만 아니라 건강 문제는 휴식-활동 일주기 리듬의 교란을 유발할 수 있고[14,15], 반대로 수면이나 휴식-활동 일주기 리듬의 교란은 여러가지 신체적·심리적 증상을 유발할 수 있어 상호연관 된다[16]. 최근 연구들에 의하면 이러한 상호관련성을 설명하는데 있어 자율신경계 기능 이상 및 스트레스, 면역기능이 중간 매개 역할을 할 수 있는 것으로 보고되고 있으며[17,18], 선행 동물 실험 연구에 의하면[19] 교감신경 활성의 증가는 불안 행동을 유발하는 등의 행위 변화를 일으킨다고 보고된 바 있다. 따라서 노인요양병원에 입원한 노인들에서 휴식-활동 행위의 일주기 리듬을 조사하고, 알파 아밀라제와 휴식-활동 일주기 리듬의 관련성을 중심으로 휴식-활동 행위의 일주기 리듬 관련 요인을 파악해볼 필요가 있다.
2. 연구 목적
본 연구에서는 노인요양병원에 입원한 경도인지장애 노인에서 웨어러블 액티그래프 기기를 이용하여 수면과 활동상태를 측정하여 휴식-활동 일주기 리듬을 확인하고, 그 관련요인을 스트레스 지표인 알파 아밀라제를 중심으로 분석하고자 한다. 구체적인 연구의 목적은 다음과 같다.
1) 노인요양병원에 입원한 경도인지장애 노인에게 웨어러블 액티그래프로 측정한 수면, 활동 상태 자료를 분석하여 이들의 휴식-활동 일주기 리듬을 평가한다.
2) 노인요양병원에 입원한 경도인지장애 노인의 일반적 특성 및 알파 아밀라제 수준에 따른 휴식-활동 일주기 리듬을 분석한다.
3) 노인요양병원에 입원한 경도인지장애 노인의 휴식-활동 일주기 리듬과 알파 아밀라제의 관련성을 중심으로 휴식-활동 일주기 리듬의 관련 요인을 파악한다.
3. 연구문제 진술
교감신경계의 활성 증가는 REM 수면 및 수면시간 증가와 같은 수면 변화와 관련이 되어 있으므로[11,12], 교감신경계의 활성을 반영하는 알파 아밀라제의 수준은 수면뿐만 아니라 휴식-활동 행위 양상에도 변화를 주어 휴식-활동 일주기 리듬에 영향을 줄 수 있을 것으로 추측된다. 또한 동물 실험 결과에서 자율신경계와 인체의 일중 리듬 간의 밀접한 관련성이 제기되고 있다[13]. 이를 기반으로 다음과 같은 연구문제를 설정하였다.
1) 입원 중인 경도인지장애 노인에서 알파 아밀라제 수준에 따라 일간안정성에 차이가 있을 것인가?
2) 입원 중인 경도인지장애 노인에서 알파 아밀라제 수준에 따라 일내 변이성에 차이가 있을 것인가?
3) 입원 중인 경도인지장애 노인에서 알파 아밀라제 수준에 따라 리듬안정성에 차이가 있을 것인가?
연구 방법
1. 연구 설계
본 연구는 노인요양병원에 입원한 경도인지장애 노인의 인지기능 연구의 일부를 활용하여 요양병원에 입원한 경도인지장애 노인의 휴식-활동 일주기 리듬을 확인하고, 교감신경 기능 및 스트레스 지표인 알파 아밀라제와의 관련성을 탐색하는 2차자료 분석 연구이다.
2. 연구 대상
원자료의 연구대상자는 경기도 지역에 위치한 4개 노인요양병원에 입원 중인 65세 이상 노인 98명으로, 자발적으로 연구 참여에 동의한 대상자들이다. 대상자 선정 기준은 치매선별용 간이정신상태검사(Mini-Mental State Examination for Dementia Screening, MMSE-DS)에서 성별, 나이, 학력을 고려한 점수상[20] 치매가 아니나, 주관적인 기억력의 장애를 호소하는 경도인지장애[21]를 보이고, 의사소통 및 거동이 가능하며, 입원한지 1주일 이상 된 자이다. 대상자들에게 액티그래프로 측정된 원자료를 이용하여 휴식-활동 일주기 리듬을 추가 분석하였다. 98명의 원자료 중 수면제 복용 여부가 누락된 6명의 자료를 제외한 92명의 자료가 분석에 이용되었다.
본 연구의 검정력을 확인하기 위해 G-power 3.1.9.7를 활용하였다. 다변량 회귀분석(multiple linear regression) 통계를 기준으로 효과크기 .15(medium), 검정력 .95 유의수준 .05, 예측변수 4개로 설정하여 산출한 최소 표본 수는 89명으로 본 연구의 대상자 수는 최소 표본수 기준을 만족하는 것으로 나타났다.
3. 연구 도구
1) 대상자의 일반적 특성
대상자의 일반적 특성은 원자료 중 연령, 성별, 신장/체중 및 체질량지수(body mass index, BMI), 교육수준, 주관적인 경제 상태, 수면제 복용 여부, 인지 수준 자료를 이용하였다. 원자료에서 신장과 체중은 가벼운 옷을 입은 상태에서 줄자와 디지털 체중계(HE-53, CAS, Shanghai, China)를 이용하여 측정되었고, BMI는 체중(kg)을 신장의 제곱(m2)으로 나누어 계산하였다. 수면제 복용 여부는 대상자의 의무기록을 확인하여 조사하였다. 인지수준은 원자료의 MMSE-DS를 이용해 수집된 자료를 이용하였다. 구체적인 자료수집 방법은 원자료를 분석한 1차 논문에 자세히 기술되어 있다[22].
2) 휴식-활동 일주기 리듬
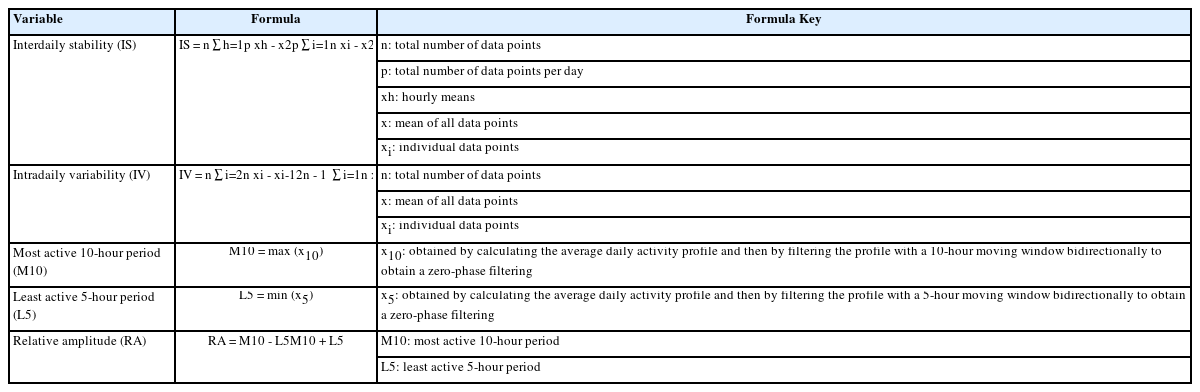
휴식-활동 일주기 리듬은 노인요양병원에 입원한 경도인지 장애 노인에게 웨어러블 액티그래프(Actigraphy GT3X+, Pensacola, Florida, USA)를 3-4일간 착용하게 하여 수집한 원자료를 활용하였으며, 비모수 분석 방법(non-parametric method)을 적용하여 분석하였다. 비모수 분석 방법은 판별력이 우수하고 민감도가 좋으며, 일반적으로 노인의 휴식-활동 일주기 리듬 분석에 많이 이용되는 것으로 알려져 있다[23]. 비모수 분석 방법에 의하면[24,25] 액티그래프로 1분마다 counter per minute (CPM) 단위로 측정된 활동의 벡터 크기(vector magnitude) 자료를 이용하여 일간 안정성(inter-daily stability), 일내 변이성(intra-daily variability), 활동이 가장 많은 10시간의 활동량(most active 10-hour period), 활동치가 가장 작은 5시간의 활동량(least active 5-hour period), 리듬 안정성(relative amplitude)을 산출할 수 있다. 일간 안정성이란 일별로 비슷한 활동 양상을 보이는 것으로, 0~1사이의 수치를 보이며 1에 가까울수록 안정성이 높음을 의미한다. 일내 변이성이란 하루동안 리듬이 단절되어 있는 정도를 의미한다. 0~2 사이의 수치를 보이며 2에 가까울수록 하루 중 리듬의 단절이 많은 것으로 볼 수 있는데, 낮잠을 자거나 밤중에 깨는 시간이 많은 경우 수치가 증가한다. 리듬 안정성이란 24시간 리듬의 견고함을 나타내는 지표로, 활동치가 가장 많은 10시간의 활동량과 활동치가 가장 적은 5시간의 활동량의 차이를 그 합으로 나누어 산출한다. 수치가 높을수록 충분한 활동량의 활동기와 안정적인 휴식기를 가진 견고한 24시간 리듬을 가지고 있는 것을 의미한다[23,24]. 일간 안정성 수치가 저하되거나 일내 변이성이 증가되어 있을수록 또는 리듬 안정성이 저하되어 있을수록 휴식-활동 일주기 리듬이 교란되어 있는 상태로 볼 수 있다. 휴식-활동 일주기 리듬의 각 지표를 산출하는 공식은 Table 1에 자세히 기술하였다.
3) 타액 알파 아밀라제
타액 알파 아밀라제는 아침 기상 후 60분간 감소하다가 이후 꾸준히 증가하는 일중 리듬 양상을 보인다[26]. 이러한 일중 변동에 의한 차이를 배제하고 일관된 알파 아밀라제 수치를 파악하기 위해 일괄적으로 오전 9시-11시 사이에 수집된 타액 검체를 이용하여 오전 알파 아밀라제 수치를 분석하였다. 타액 알파 아밀라제 수치는 교감신경이 활성화되거나, 스트레스를 받는 경우 증가하는 것으로 알려져 있다[8,9].
타액 검체는 Salimetrics 사의 oral swab (P/N5001.02; State College, PA, USA) 수집 용기를 이용하여 수집되었으며, 분석을 위해 임상검사 전문 의료기관인 녹십자랩셀에 의뢰하였다. 알파 아밀라제 분석에는 Salimetrics salivary alpha-amylase assay kit (Catalog No. 1-1902; Salimetrics)이 이용되었고, 분석과정은 Salimetrics사가 제시한 프로토콜에 따라 진행되었다.
4. 자료 수집 방법
본 연구는 선행 연구의 1차 자료를 활용하여 2차 분석한 연구로, 전산으로 코드화된 자료를 이용하여 분석하였다. 원자료의 자료 수집기간은 2018년 7월부터 2020년 1월이었으며, 본 연구에서 사용한 2차 자료의 분석은 2022년 6월에서 2023년 1월까지의 기간에 진행되었다.
5. 자료 분석 방법
본 연구에서 수집된 자료는 SPSS Statistics ver. 25 for Windows (IBM Corp., Armonk, NY, USA) 통계프로그램을 이용하여 분석하였다. 대상자의 일반적 특성과 휴식-활동 일주기 리듬 지표, 알파 아밀라제 수치는 실수와 백분율, 평균을 산출하고, Shapiro-Wilk 방법을 이용하여 정규성을 검정하였다. 정규성 검정 결과, 나이, 인지수준, 알파 아밀라제 수치, 일간 안정성, 활동이 가장 많은 10시간의 활동량, 활동치가 가장 작은 5시간의 활동량, 리듬 안정성은 정규 분포를 하지 않는 것으로 확인되어 추론 통계 분석시에 로그 변환하여 분석하였다. 휴식-활동 일주기 리듬과 대상자의 일반적 특성, 알파 아밀라제의 상관성을 확인하기 위해 피어슨 상관분석(Pearson’s correlation)을 시행하였으며, 휴식-활동 일주기 리듬의 관련 요인을 분석하기 위해 다중선형회귀분석(multiple linear regression)을 시행하였다. 휴식-활동 일주기 리듬과 유의한 상관성을 보였던 변수를 다중선형회귀분석 변수로 포함하여 분석하였다. 통계적 유의 수준은 p < .05를 기준으로 하였다.
6. 윤리적 고려
원자료는 인하대학교 기관생명윤리위원회의 승인을 받았으며(IRB No. 180511-1AR), 자료수집이 진행된 각 노인요양병원 기관장의 승인을 받고 수집되었다. 원자료에서 수집된 자료와 개인정보는 무기명으로 부호화하여 입력되었으며, 잠금장치가 있는 곳에 보관되었다. 본 연구는 인하대학교 기관생명윤리위원회의 심의면제(IRB No. 230912-1A)를 받았다.
연구 결과
1. 대상자의 일반적 특성 및 휴식-활동 일주기 리듬
본 연구 대상자의 평균 연령은 75.94세이며, 이 중 54명(58.7%)이 여성이었다(Table 2). 평균 BMI는 22.83이었고, 경제상태는 중간이라고 답한 대상자가 60명(65.2%)으로 가장 많았으며, 인지수준은 MMSE-DS 평균 22.24점이었다. 대상자들의 알파 아밀라제 수치는 평균 77.02 U/ml, 중위수 79.08 U/ml이었다.
휴식-활동 일주기 리듬 지표들을 보면, 일별로 비슷한 활동 양상을 보이는 정도인 일간 안정성은 평균 0.23, 하루동안 리듬이 단절되어 있는 정도 일내 변이성은 0.73, 활동이 가장 많은 10시간의 활동량은 평균 1343.91 CPM, 활동치가 가장 작은 5시간의 활동량은 75.76 CPM, 24시간 리듬의 견고함을 나타내는 리듬 안정성은 평균 0.88이었다.
2. 대상자의 휴식-활동 일주기 리듬과 일반적 특성, 알파 아밀라제 수치와의 관련성
휴식-활동 일주기 리듬 지표 중 일간 안정성은 BMI 및 인지수준, 알파 아밀라제 수준과 유의한 상관관계를 보였는데(Table 3), BMI가 높을수록(r = .26, p = .018), 인지수준이 높을수록(r = .25, p = .017) 일간 안정성이 좋았다. 또한 오전 알파 아밀라제 수치가 높을수록 일간 안정성이 유의하게 좋은 것으로 나타났다(r = .39, p = .004). 일내 변이성은 여성 노인에서 유의하게 낮았다(r = -.28, p = .008).

Associations of Rest-Activity Patterns with General Characteristics of Participants and Alpha Amylase (N = 92)
활동이 가장 많은 10시간의 활동량 수치는 나이가 적을수록(r = -.25, p = .018), 여성일수록(r = .21, p = .043), 인지수준이 높을수록(r = .30, p = .004), 알파 아밀라제 수치가 높을수록(r = .30, p = .027) 유의하게 많았다. 리듬 안정성은 나이가 적을수록(r = -.22, p = .039), BMI가 높을수록(r = .32, p = .003), 인지수준이 높을수록(r = .27, p = .009) 높았으며, 오전 알파 아밀라제 수치가 높을수록 리듬 안정성이 유의하게 좋았다(r = .32, p = .023).
주관적 경제상태나 수면제 복용 여부는 휴식-활동 일주기 리듬 지표들과 유의한 관련성을 보이지 않았다.
3. 휴식-활동 일주기 리듬에 영향을 미치는 요인
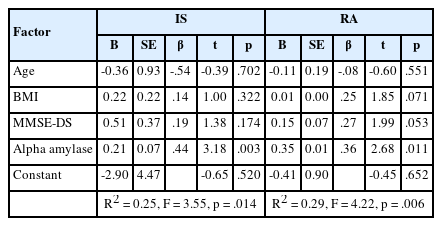
휴식-활동 일주기 리듬 지표 중 알파 아밀라제 수치와 유의한 상관성을 보였던 일간 안정성, 리듬 안정성에 대해 다중선형회귀분석을 시행하였다(Table 4). 잔차 분석 결과, 두 회귀모형은 모형의 선형성과 오차의 등분산성, 정규성을 만족하였다. Durbin-Watson 지수는 각각 2.07, 1.66으로 종속변수인 일간 안정성은 자기상관성 없이 독립적이었다. 공차(tolerance)는 .78~.95로 .10이상이었고, 분산팽창지수(variance inflation factors)는 1.05~2.10으로 10이하이므로 다중공선성의 문제는 없었다.
다중회귀분석 결과, 일간 안정성은 오전에 측정한 알파 아밀라제 수치가 높을수록 유의하게 좋았으며(β = .44, p = .003), 나이, BMI, 인지수준은 유의한 영향을 미치지 않았다. 이 회귀모형의 설명력은 25.0%였고, 모형은 유의하였다(F = 3.55, p = .014). 리듬 안정성의 경우에도 알파 아밀라제 수치가 높을수록 유의하게 좋았으며(β = .36, p = .011), 나이, BMI, 인지수준은 유의한 영향을 미치지 않았으며, 회귀모형의 설명력은 29.0%였고, 모형은 유의하였다(F = 4.22, p = .006).
논의
본 연구는 노인요양병원에 입원한 경도인지장애 노인에게 웨어러블 액티그래프를 착용하게 하여 측정한 수면 및 활동 자료를 분석함으로써 이들의 휴식-활동 일주기 리듬을 확인하고, 이에 영향을 주는 요인을 교감신경계 활성 지표인 타액 알파 아밀라제를 중심으로 확인하였다. 이를 통해, 추후 이들의 건강한 휴식-활동 일주기 리듬 유지를 위해 고려해야 할 사항에 대한 기초자료를 제시하고자 한다.
본 연구에서 노인요양병원에 입소한 경도인지장애 노인들의 휴식-활동 일주기 리듬 지표들은 일간 안정성 0.23, 일내 변이성 0.73, 리듬 안정성 0.88이었으며, 이는 건강한 지역사회 거주 노인들에서[27] 각각 0.52, 0.68, 0.83인 결과와 비교하였을 때, 매일 규칙적인 24시간 주기 안정성이 저하되어 있고, 낮에 자거나 야간 수면 중 깨는 등의 일내 변이성이 높으나, 활동기 활동량과 수면시 활동량의 차이를 나타내는 리듬 안정성은 양호한 편인 것으로 보인다. 이러한 휴식-활동 일주기 리듬 양상은 지역사회에 거주하는 인지장애 위험이 있는 노인[28]에서도 각각 0.53, 0.80, 0.90으로, 일내 변이성이 높았던 결과와 유사한 양상으로 생각된다.
그러나 특이하게도 본 연구 대상자들은 일간 안정성이 매우 낮은 수치를 보였는데, 이는 중환자실 입원 환자[29]에서 보고된 0.42에 비해서도 매우 낮은 수치로, 입원 중인 노인들이 매일 규칙적인 24시간 주기의 리듬을 보이지 않음을 알 수 있었다. 일반적으로 일중 리듬은 내적 시계(internal clock) 외에도 식사시간이나 사회적 일상 생활 시간에 맞추어지는 것으로 알려져 있다[30]. 식사 제공 시간이 일정하고, 비교적 단순한 일상생활을 하는 입원 노인들에게 휴식-활동 일주기 리듬이 교란되어 있는 것은 다소 의외의 결과이다. 인지기능에 문제가 있는 경우[31]나 병원 및 시설에 입소한 경우[32], 불규칙한 수면-각성 양상을 보이는 것으로 알려져 있고, 증가된 대뇌 전두엽의 백질병변(white matter lesion) 및 시상으로부터의 수면 신호 전달 장애는 낮은 일간 안정성과 유의한 관련성이 있는데[28], 이러한 점들이 본 연구에서 경도인지장애를 호소하는 고령의 입원한 노인들의 저하된 일간 안정성 수치에 반영된 것일 수 있다. 불규칙한 휴식-활동 일주기 리듬은 심장질환 발생[33] 및 사망률 증가[34]와도 관련되므로, 입원중인 경도인지장애 노인들이 일정한 야간 수면 시간을 유지하고, 주간 수면을 최소화하는 등의 규칙적인 휴식-활동 일주기 리듬을 유지할 수 있도록 간호사들이 관심을 기울이고 체계적인 전략을 강구할 필요가 있다.
본 연구에서 알파 아밀라제 수준이 높을수록 휴식-활동 일주기 리듬 지표 중 일별 안정성 및 리듬 안정성이 유의하게 좋은 것으로 나타났고, 이러한 관련성은 나이, 비만도, 인지수준 요인과 함께 투입하여 분석한 회귀분석에서도 여전히 유의하였다. 선행연구에 의하면 교감신경 활성이 높은 경우 REM 수면이 증가되는 것으로 보고되었고[35], 이런 경우 휴식-활동 일주기 리듬에도 부정적인 영향을 미칠 수 있을 것으로 추측될 수 있는 점을 생각할 때, 본 연구결과는 다소 의외였다. 이러한 이유로는 본 연구 대상자들은 정상 성인을 대상으로 했던 선행연구와 달리 입원한 노인이었기 때문일 수 있다. 입원 노인은 신체적/심리적 스트레스로 인해 교감신경이 활성화되어 있을 수 있는데, 본 연구 대상자들의 알파 아밀라제 수치는 77.02 U/ml로, 지역사회 거주 일반 노인의 46.6 U/ml [36]보다 높은 수치였다. Klaus 등[37]은 스트레스 상황인 경우에는 알파 아밀라제 수치가 높은 것이 오히려 수면의 질을 증진시키고, 수면 시간이 증가하는 것으로 보고하였는데, 본 연구 대상자들이 입원 및 급성 질환과 같은 스트레스 상황으로 전반적으로 알파 아밀라제 수치가 증가되어 있었기 때문에 교감신경 활성도가 높을수록 수면이나 휴식-활동 일주기 리듬이 좋아지는 결과를 보였을 수 있다. 반대로, 인체의 규칙적인 일주기 리듬을 유발하는 내적 시계(internal clock)가 수면-각성 주기나 자율신경 기능을 조절하여, 인체가 스트레스 등에 잘 반응할 수 있도록 하기도 하는데[38], 규칙적인 휴식-활동 일주기 리듬을 가지고 있는 노인들이 스트레스에 적절히 반응하는 교감신경계 기능이 잘 유지되고 있을 가능성도 배제할 수는 없겠다. 또한, 노인들은 전반적으로 교감신경의 활성이 저하되어 있고 교감신경 활성의 저하는 사망률 증가와도 관련이 있는 것으로 알려져 있는데[39], 노인들에서는 오히려 알파 아밀라제 수치가 높은, 즉 교감신경 활성이 증가되어 있는 경우에 건강한 휴식-활동 일주기 리듬을 가지고 있을 수 있고, 이처럼 건강한 휴식-활동 일주기 리듬을 유지하는 것이 이들의 심장질환 발생이나 사망률 저하[33,34]와 관련되는 것일 수도 있겠다. 따라서, 노인들에서는 교감신경 활성도를 유지 또는 증가시킴으로써 타액 알파 아밀라제를 일정 수준 이상으로 유지하는 것이 이들의 건강한 휴식-활동 일주기 리듬 유지에 긍정적인 영향을 주는 것으로 추측할 수 있겠으며, 이들에게 신체활동과 같이 교감신경 활성도를 증가시켜[40] 타액 알파 아밀라제 분비를 자극할 수 있는 중재를 제공하는 것이 일간 안정성과 리듬 안정성을 높여 건강한 휴식-활동 일주기 리듬을 유지하는데 도움이 될 수 있겠다. 그러나 관련 연구가 많지 않아 반복 연구가 필요하며, 추후에 교감신경 활성을 반영하는 알파 아밀라제 외에도 심리적 스트레스 수준까지 함께 측정하여 분석하는 연구가 진행된다면 자율신경계 기능과 휴식-활동 일주기 리듬간의 관련성을 구체적으로 설명할 수 있을 것으로 생각한다.
흥미롭게도 본 연구 결과, 대상자들의 비만도가 높을수록 일별 안정성이 좋고, 리듬 안정성이 좋은 것으로 나타났다. 이러한 결과는 선행연구에서 BMI가 높은 비만 성인이나 노인일수록 유의하게 교란된 휴식-활동 일주기 리듬을 보였던 결과와 일치하지 않았다[24,41]. 선행 연구들에서는 지역사회에 거주하는 비교적 건강한 서양인 대상자들이었고, 이들의 비만도는 평균 27.1~27.5 정도로, 본 연구 대상자인 노인요양병원 입원 노인들의 평균 22.83보다 훨씬 높았다. 일반적으로 비만이거나 대사 기능에 이상이 있는 경우 리듬 안정성이 떨어지는 등 건강하지 못한 휴식-활동 일주기 리듬을 보이는데[42,43], 본 연구 대상자들은 노인요양병원에 입원한 노인들로 전반적으로 BMI가 낮고 비만인 대상자가 거의 없었던 노인들이었기 때문에 선행 연구 결과와 상이한 결과를 보였을 수 있다. 이로 미루어 볼 때, 이러한 입원한 노인들에서는 일정 수준 이상의 BMI를 유지하는 경우에 건강한 휴식-활동 일주기 리듬을 가지고 있다고 볼 수 있는데, Kume 등[44] 역시 근육 감소(sarcopenia)가 있는 노인에서 오히려 휴식-활동 일주기 리듬이 더욱 교란되어 있었다고 보고한 바 있다.
본 연구의 제한점은 다음과 같다. 첫째, 원자료에서 측정한 3-4일간의 액티그래프 데이터를 이용하여 휴식-활동 일주기 리듬을 분석한 점이다. 추후 연구에서는 일주일간의 액티그래프 데이터를 분석하여 휴식-활동 일주기 리듬을 조사할 것을 제언한다. 둘째로 타액 알파 아밀라제를 하루만 수집하여 분석하였던 점이다. 그러나 타액 알파 아밀라제는 순간적인 영향요인들의 영향을 잘 받지 않고 비교적 굳건한 일주기 리듬을 가지고 있는 편이므로[26], 하루의 알파 아밀라제 측정치도 평균치를 어느 정도 반영하는 것으로 간주할 수 있을 것으로 보인다. 또한 알파 아밀라제 수치는 침샘 기능 등 구강 관련 기능에 의해 영향을 받는데[45], 그러한 점을 고려하지 못했다. 세번째로 본 연구는 2차분석 연구인 관계로 대상자들의 복용약이나 수면무호흡증 상태, 스트레스 수준 등과 같이 휴식-활동 일주기 리듬에 영향을 줄 수 있는 다른 요인들을 파악하지 못하였다. 추후 연구에서 이를 고려한 분석이 필요하다. 마지막으로, 본 연구는 단면 연구(cross-sectional study)인 관계로 인과 관계를 설명하기 어려우므로 본 연구 결과를 해석하는데 있어 주의를 기울여야 한다. 본 연구의 제한점에도 불구하고 본 연구는 국내 노인요양병원에 입소한 노인들의 휴식-활동 일주기 리듬을 분석하고, 타액 알파 아밀라제와의 관련성을 파악하여, 간호사들이 이들의 건강한 휴식-활동 일주기 리듬 유지에 대해 관심을 두어야 한 필요성을 제시하고, 이를 위해 고려해야 할 사항에 대한 근거자료를 제공할 수 있을 것으로 생각한다.
결론
본 연구 결과, 노인요양병원에 입원한 경도인지장애 노인들의 휴식-활동 일주기 리듬 지표들은 일간 안정성이 매우 저하되어 있었고 일내 변이성이 다소 높아, 낮잠을 자거나 밤중에 깨어 있는 경향이 있고 규칙적인 24시간 주기를 갖지 않는 것으로 나타났다. 특히 일간 안정성 저하, 즉 24시간 주기의 불규칙성이 심하였으므로, 이들이 일정한 야간 수면 시간을 유지하고, 주간 수면을 최소화할 수 있도록 간호사들이 각별한 관심을 기울이고, 이를 위한 체계적인 전략을 강구할 필요가 있다. 또한 알파 아밀라제 수준이 증가되어 있을수록, 비만도가 높을수록 일간 안정성이나 리듬 안정성 같은 휴식-활동 일주기 리듬 지표가 건강한 것으로 나타나, 노인요양병원에 입원한 경도인지장애 노인들의 경우 신체활동 등과 같이 교감신경을 활성화시킬 수 있는 중재를 통해 일정 수준 이상의 타액 알파 아밀라제 수치를 유지하고, 적절한 비만도를 유지하는 것이 규칙적인 휴식-활동 일주기 리듬 유지에 도움이 될 수 있음을 시사한다.
본 연구를 통해 다음과 같이 추후 연구를 제언하고자 한다. 첫째, 일주일 이상 수집한 액티그래프 자료를 이용하여 휴식-활동 일주기 리듬을 분석한 반복 연구가 필요하다. 둘째 심리적 스트레스를 함께 측정하여 신체적/심리적 스트레스와 알파 아밀라제, 휴식-활동 일주기 리듬 간의 관련성을 규명하는 연구 및 다양한 휴식-활동 일주기 리듬 관련요인을 통합적으로 분석하는 연구를 제언한다.
Notes
CONFLICT OF INTEREST
The authors declared that no conflict of interest.
AUTHORSHIP
MHS contributed to the conception, design of the study; interpreted the result; drafted the manuscript; critically reviewed and revised the manuscript; JHC conducted the data trimming and analysis; MHS supervised the whole study process; All authors read and approved the final manuscript.
FUNDING
None.
DATA AVAILABILITY
The participants of this study did not give written consent for their data to be shared publicly or with third party, so due to the sensitive nature of the research supporting data is not available.