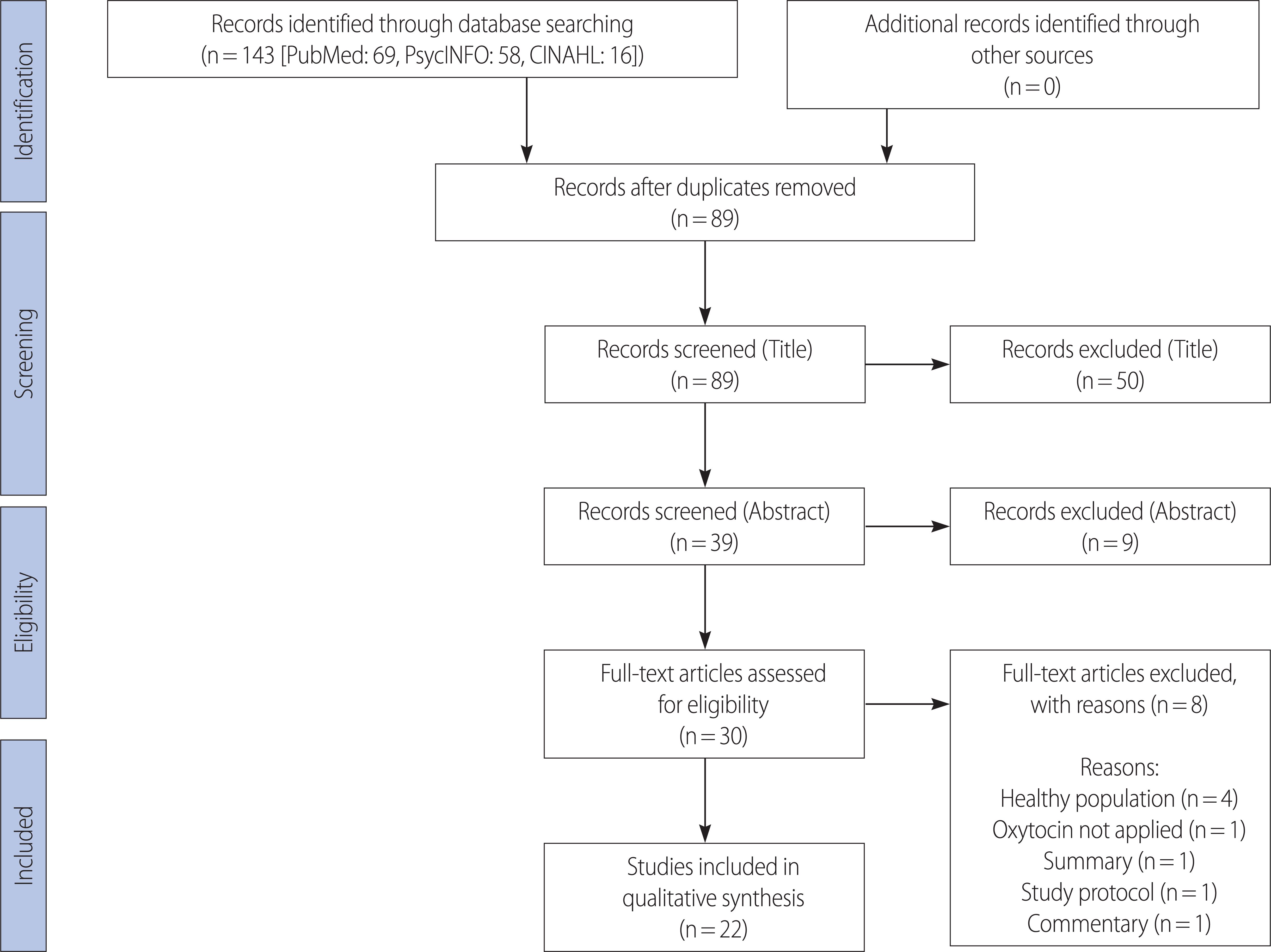
žĄú Ž°†
1. žóįÍĶ¨žĚė ŪēĄžöĒžĄĪ
2. žóįÍĶ¨žĚė Ž™©ž†Ā
3. žóįÍĶ¨ Žį©Ž≤ē
1) žóįÍĶ¨ žĄ§Í≥Ą
2) Ž¨łŪóĆ žĄ†ž†ēÍłįž§ÄÍ≥ľ ž†úžôłÍłįž§Ä
3) Ž¨łŪóĆ Í≤ÄžÉČ ŽįŹ žĄ†ž†ē
4) žěźŽ£Ć ž∂Ēž∂ú ŽįŹ Ž∂ĄžĄĚ
5) Ž¨łŪóĆžĚė žßą ŪŹČÍįÄ
žóįÍĶ¨ Í≤įÍ≥ľ
1. Í≤Ćžě¨ ŽÖľŽ¨łžĚė ŪäĻžĄĪ
Table 1.
| First author (yr) | Country | Design | N randomized (OT, placebo) | N male (%) | Mean age | INOT Administration | Placebo | Control group |
|---|---|---|---|---|---|---|---|---|
|
|
||||||||
| Single administration | ||||||||
| Pitman et al. (1993) [A1] | USA | BS | 43 (15, 15) | 43 (100.0 ) | 44.2 | 20 IU, 1 hr before OA | Placebo (saline) in 2-mL solution (same used for INOT) | - |
| Eidelman et al. (2015) [A2] | Israel | WS | 28 (28, 28) | 28 (100.0) | 27.0 | 24 IU, 45 min before OA | Placebo, custom-designed to match drug minus OT | 15 trauma-unexposed |
| Palgi et al. (2016)† [A3] | Israel | WS | 32 (32, 32) | 23 (72.0) | 43.4 | 24 IU, 45 min before OA | Same saline solution where OT was dissolved but without the drug itself. Placebo, not specified. | 30 matched healthy controls |
| Frijling et al. (2016a) [A4] | Netherlands | BS | 44 (24, 20) | 18 (41.0) | 30.8 | 40 IU, 45 min before OA | 0.8% NaCl solution | - |
| Frijling et al. (2016b) [A5] | Netherlands | BS | 41 (23, 18) | 17 (41.4) | 36.0 | 40 IU, 45 min before OA | 0.8% NaCl solution | - |
| Koch et al. (2016a)†† [A6] | Netherlands | WS | 37 (37, 37) | 21 (56.8) | 40.2 | 40 IU, 45 min before OA | Saline, NaCl 0.9% | 40 police officers without PTSD |
| Koch et al. (2016b)§ [A7] | Netherlands | WS | 37 (37, 37) | 21 (56.8) | 40.2 | 40 IU, 45 min before OA | Saline, NaCl 0.9% | 40 police officers without PTSD |
| Nawijn et al. (2016)§ [A8] | Netherlands | WS | 40 (40, 40) | 21 (52.5) | 40.7 | 40 IU, 50-70 min before OA | Saline, NaCl 0.9% | 37 trauma-exposed |
| Palgi et al. (2017)¶ [A9] | Israel | WS | 32 (32, 32) | 23 (72.0) | 43.4 | 24 IU, 45 min before OA | Placebo, not specified | 30 matched healthy controls |
| Sack et al. (2017) [A10] | Germany | WS | 35 (35, 35) | 0 (0.0) | 39.8 | 24 IU, 45 min before OA | Same ingredients as the INOT spray except OT | 10 healthy female controls |
| Nawijn et al. (2017)# [A11] | Netherlands | WS | 40 (40, 40) | 21 (52.5) | 40.7 | 40 IU, 50-70 min before OA | Saline, NaCl 0.8% | 37 trauma-exposed |
| Flanagan et al. (2018a) [A12] | USA | WS | 17 (17, 17) | 9 (52.9) | 36.3 | 24 IU, 45 min before OA | Saline, not specified | 16 childhood trauma exposed |
| Flanagan et al. (2019a) [A13] | USA | WS | 33 (33, 33) | 15 (45.5) | 37.8 | 24 IU, 45 min before OA | Saline | 16 childhood trauma exposed |
| Flanagan et al. (2019b) [A14] | USA | BS | 67 (32, 35) | 67 (100.0) | 49.0 | 40 IU, 45 min before OA | Saline | - |
| Koch et al. (2019) [A15] | Netherlands | WS | 37 (37, 37) | 21 (56.0) | 40.2 | 40 IU, 80 min before OA | Saline, NaCl 0.9% | 40 police officers without PTSD |
| Stauffer et al. (2019) [A16] | USA | WS | 47 (47, 47) | 47 (100.0) | 50.6 | 20 or 40 IU, 30 min before OA | Placebo, not specified | - |
| Morrison et al. (2020) [A17] | USA | WS | 97 (97, 97) | 97 (100.0) | 49.6 | 20 or 40 IU or placebo each week, for 3 weeks, each done 135 min before OA | Placebo, not specified | 43 healthy male |
| Multiple administration | ||||||||
| Zuiden et al. (2017) [A18] | Netherlands | BS | 107 (53, 54) | 54 (50.5) | 35.5 | Assess CAPS at baseline (within 10 days posttrauma) 40 IU BID (80 IU/ day) for 8 days, OA at 1.5, 3, and 6 months posttrauma | Saline, NaCl 0.9% | 54 adults with moderate to severe acute distress |
| Flanagan et al. (2018b) [A19] | USA | BS | 17 (8, 7) | 14 (82.3) | 43.8 | 40 IU each week, for 8 weeks, each done 45 min before OA | Placebo, not specified. | 18 trauma-exposed |
| Engel et al. (2020) [A20] | Netherlands | BS | 100 (49, 51) | 54 (54.0) | 34.2 | Assess CAPS at baseline (within 10 days posttrauma) 40 IU BID (80 IU/ day) for 7 days, OA at 1.5, 3, and 6 months posttrauma | Placebo, not specified | 27 women using hormonal conception, 19 naturally cycling women |
| Flanagan et al. (2020) [A21] | USA | BS | 188 (94, 94) | Not specified | Not specified | Assess CAPS at baseline, 40 IU each week, for 10 weeks, each done 30 min before PE session, OA at week 5, 10, and at 3, 6 months follow-up | Saline | 94 veterans with PTSD |
| Sippel et al. (2020) [A22] | Netherlands | BS | 13 (6, 7) | 10 (76.9) | 42.8 | Assess CAPS at baseline 40 IU each week, for 8 weeks (PE session 2 to 9), Each done 45 min before PE session, OA at session 10 | Placebo, not specified | 7 PTSD patients with placebo |
2. žóįÍĶ¨ ŽĆÄžÉĀžěźžĚė ŪäĻžĄĪÍ≥ľ žė•žčúŪ܆žč† Ūą¨žó¨ Žį©Ž≤ē
3. žė•žčúŪ܆žč†žĚė žĻėŽ£Ćž†Ā Ūö®Í≥ľ ŪŹČÍįÄ žł°ž†ē Žį©Ž≤ēÍ≥ľ Í≤įÍ≥ľ
Table 2.
| Author (yr) | Purpose | Task | Parameters | ||
|---|---|---|---|---|---|
|
|
|||||
| Socio behavioral measures | Neuronal Imaging | Biomarkers | |||
|
|
|||||
| Single administration | |||||
| Pitman et al. (1993) [A1] | The effects of vasopressin and OT on human emotional memory | 2 min mental arithmetic task | Heart rate (BPM), Skin conductance (őľS), Left lateral frontalis electromyographic (őľV) | ||
| Eidelman et al. (2015) [A2] | The effects of OT on spontaneous brain oscillatory activity | No task | Spontaneous brain activity of two dlPFC regions | ||
| Palgi et al. (2016) [A3] | The effects of OT on the capacity for compassion among patients with PTSD and among healthy control (HC) participants | Compassion task | Compassion Biological Motion Task First-and Second-Order ToM (Yoni Task, Cognitive Empathy) | ||
| Frijling et al. (2016a) [A4] | The effects of a single OT administration on resting-state functional connectivity of amygdala-centered emotion regulation and salience networks in recently trauma-exposed individuals with moderate-to-severe acute distress | Face-matching task | Resting-state functional connectivity | ||
| Frijling et al. (2016b) [A5] | The effects of OT on amygdala reactivity to happy, neutral, and fearful faces in recently trauma-exposed individuals | Face-matching task | Amygdala reactivity | ||
| Koch et al. (2016a) [A6] | The effects of a single intranasal OT administration on subjective anxiety and functional connectivity of BLA and CeM amygdala subregions with prefrontal areas (vmPFC) and salience processing areas (insula and dACC) | Face-matching task | Anxiety, nervousness, happiness, and sadness visual analog scales (VAS, 0-100) | CeM, BLA Amygdala functional connectivity | |
| Koch et al. (2016b) [A7] | The effects of OT on amygdala reactivity towards emotional faces in trauma-exposed police officers with and without PTSD | Face-matching task | Bilateral amygdala reactivity | ||
| Nawijn et al. (2016) [A8] | The effects of OT administration on neural motivational processing during monetary reward and loss anticipation in trauma-exposed police officers with and without PTSD, using a monetary incentive delay (MID) task | A monetary incentive delay (MID) task | Reward pathway reactivity | ||
| Palgi et al. (2017) [A9] | Explore empathic deficits in PTSD and to characterize the association between such deficits and the severity of PTSD symptoms | Biological Motion Task |
Emotional Empathy (anger, disgust, fear, happiness, sadness) Cognitive Empathy (ToM task) |
||
| Sack et al. (2017) [A10] | The effects of OT on provoked PTSD symptoms in female PTSD patients | The trauma script challenge | Provoked PTSD symptoms (RSDI questionnaire) | ||
| Nawijn et al. (2017) [A11] | The effects of OT to enhance neural sensitivity to social reward and potentially decrease sensitivity to social punishment in PTSD patients | The social incentive delay (SID) task | Neural responses to social reward and punishment | ||
| Flanagan et al. (2018a) [A12] | The effects of OT on amygdala reactivity to negative emotional cues between individuals with PTSD resulting from childhood trauma versus individuals who had childhood trauma exposure but did not develop PTSD | N-back task | Working memory performance | Left DLPFC-anterior cingulate connectivity | |
| Flanagan et al. (2019a) [A13] | The effects of OT versus placebo on amygdala reactivity to fearful faces among childhood-trauma exposed individuals with PTSD and without PTSD | Facial affect recognition task | Left and right amygdala responses reactivity | ||
| Flanagan et al. (2019b) [A14] | The effects of OT versus placebo on social stress and associated cortisol reactivity among Veterans with co-occurring PTSD and AUD | No task | Salivary cortisol reactivity | ||
| Koch et al. (2019) [A15] | The effects(behavioral and neural) of OT on distraction as emotion regulation strategy in male and female police officers with and without PTSD | The distraction task | Left thalamus activity, Right striatal activity | ||
| Stauffer et al. (2019) [A16] | The effects of OT versus placebo in reducing cue-induced alcohol craving and HR response in male patients with comorbid AUD and PTSD | Cue-induced craving task | Self-Reported Craving | ||
| Morrison et al. (2020) [A17] | The effects of OT on HC and on people with comorbid posttraumatic stress disorder and alcohol use disorder | The imitation-inhibition task | Automatic imitation/congruency effect | ||
| Multiple administration | |||||
| Zuiden et al. (2017) [A18] | The effects of repeated OT administration on clinician-rated PTSD symptom severity at 1.5 months posttrauma | No task | Clinician-Rated PTSD Symptoms (CAPS) | ||
| Flanagan et al. (2018b) [A19] | Examine the feasibility, safety, and preliminary efficacy of augmenting PE with OT | No task | CAPS for DSM-5, PTSD checklist for DSM-5, Beck-depression inventory, Helping alliance questionnaire, Client satisfaction | ||
| Engel et al. (2020) [A20] | The effects of early (posttraumatic) autonomic and endocrine markers on PTSD symptom development | No task |
Autonomic and endocrine markers (1) Heart rate (variability) (2) Saliva resting cortisol, morning (3) Saliva cortisol (4) Saliva cortisol awakening response (CAR) (5) Cortisol suppression by dexamethasone (6) Blood resting oxytocin |
||
| Flanagan et al. (2020) [A21] | The effect of OT administration combined with PE therapy to (1) Reduce PTSD symptom severity, (2) Accelerate the rate of PTSD symptom improvement, and (3) Improve PE adherence and retention rates | No task | CAPS-5, PCL -5 | ||
| Sippel et al. (2020) [A22] | Associations between PTSD symptom severity and peripheral OT levels measured in plasma before and after a course of prolonged exposure (PE) for PTSD | No task |
PTSD symptom severity (1) CAPS-5 (2) PCL -5 |
Peripheral oxytocin level | |
OT=oxytocin; PTSD=post-traumatic stress disorder; PBO=placebo; PFC=prefrontal cortex; vmPFC=ventromedial PFC; DSM=Diagnostic and Statistical Manual of Mental Disorder; dACC=dorsal anterior cingulate cortex; CeM=central medial amygdala; BLA=basolateral; dlPFC=dorsolateral PFC, RSDI=Responses to Scrip-Driven Imagery Scale; AUD=Alcohol Use Disorder; PCL=PTSD checklist.
Table 3.
| Author (yr) | Parameters | Outcome |
|---|---|---|
|
|
||
| Socio behavioral measures | ||
| Koch et al. (2016a) [A6] | Anxiety, Nervousness, Happiness, and Sadness visual analog scales (VAS, 0-100) | OT: Subjective anxiety‚Üď; Nervousness‚Üď |
| Palgi et al. (2016) [A3] |
Compassion Biological motion task First- and Second-order ToM (Yoni Task, Cognitive Empathy) |
PBO: Compassion score‚Üď OT (F): Compassion score‚ÜĎ |
| Palgi et al. (2017) [A9] | Emotional empathy (Anger, Disgust, Fear, Happiness, Sadness) | |
| Cognitive empathy (ToM task) | No main effects were found | |
| Sack et al. (2017) [A10] | Provoked PTSD symptoms (RSDI questionnaire) | OT: PTSD symptoms‚Üď |
| Flanagan et al. (2018a) [A12] | Working memory performance |
PBO: Working memory performance‚Üď OT: Working memory performance (-) |
| Stauffer et al. (2019) [A16] | Self-reported craving | No main effect were found |
| Morrison et al. (2020) [A17] | Automatic imitation | OT: Log CE‚ÜĎ |
| Zuiden et al. (2017)‚Ć [A18] | Clinician-rated PTSD symptoms (CAPS) | OT: CAPS scores‚Üď |
| Flanagan et al. (2018b)‚Ć [A19] | CAPS for DSM-5, PTSD checklist for DSM-5, BDI, Helping alliance questionnaire, Client satisfaction, | OT: PCL-5 score marginally‚Üďat end of treatment |
| Flanagan et al. (2020)‚Ć [A21] | CAPS-5, PCL-5 | OT: CAPS-5 scores‚Üď; PCL-5 scores‚Üďfollowing 10 weeks of treatment |
| Sippel et al. (2020)‚Ć [A22] | PTSD symptom severity | OT: PCL-5 score marginally‚Üďat end of treatment |
| (1) CAPS-5 | PCL-5 score significantly‚Üďat session 3 | |
| (2) PCL-5 | ||
| Biomarkers | ||
| Pitman et al. (1993) [A1] | Heart rate (BPM), Skin conductance (őľS), left lateral frontalis electromyographic (őľV) | (Linear contrasts: vasopression>Pitressin>Oxytocin) |
| OT: Heart rate (BPM): F (1,40)<1 | ||
| Skin conductance (őľS): F (1,40)=3.7, p=.06 | ||
| Left lateral frontalis electromyographic (őľV): F (1,40)=10.4, p=.003 | ||
| Flanagan et al. (2019b) [A14] | Salivary cortisol reactivity | OT: cortisol reactivity‚Üď |
| Engel et al. (2020)† [A20] | Autonomic and endocrine markers | OT (F): Higher oxytocin concentrations were associated with higher PTSD symptoms |
|
(1) Heart rate (variability) (2) Saliva resting cortisol, morning (3) Saliva cortisol (4) Saliva cortisol awakening response (CAR) (5) Cortisol suppression by dexamethasone (6) Blood resting oxytocin |
||
| Sippel et al. (2020)† [A22] | Peripheral oxytocin level | No main effects were found |
| Neuronal Imaging | ||
| Eidelman et al. (2015) [A2] | Spontaneous brain activity of two dlPFC regions |
HC: Left dorsolateral prefrontal cortex (dlPFC), Superior frontal gyrus (SFG), the middle frontal gyrus (MFG) reactivity‚ÜĎ OT: Left dorsolateral prefrontal cortex (dlPFC), Superior frontal gyrus (SFG), the middle frontal gyrus (MFG) reactivity (-) |
| Frijling et al. (2016a) [A4] | Resting-state functional connectivity |
OT: Amygdala-insula connectivity‚ÜĎ, Amygdala-vmPFC connectivity‚Üď PBO: Amygdala-vmPFC connectivity‚ÜĎ |
| Frijling et al. (2016b) [A5] | Amygdala reactivity |
OT: Right Amygdala reactivity‚ÜĎ OT (F): Left Amygdala reactivity‚ÜĎ |
| Koch et al. (2016a) [A6] | CeM, BLA Amygdala functional connectivity |
OT (M): Right CeM-left vmPFC‚ÜĎ PBO (M): Right CeM-left vmPFC‚Üď OT (F): Right BLA-right dACC‚Üď OT (F): Right BLA-left dACC‚Üď HC OT (M): Right BLA-left dACC‚Üď |
| Koch et al. (2016b) [A7] | Bilateral amygdala reactivity |
OT: Left Amygdala reactivity‚Üď HC OT: Left Amygdala reactivity‚ÜĎ |
| Nawijn et al. (2016) [A8] | Reward pathway reactivity | OT: Striatum (putamen), Right dACC, right insula‚ÜĎ |
| Nawijn et al. (2017) [A11] | Neural responses to social reward and punishment |
PBO: Left anterior insula‚Üď OT: Left anterior insula (-), Right putamen‚ÜĎ |
| Flanagan et al. (2018a) [A12] | Left dlPFC-anterior cingulate connectivity | OT: Left dlPFC-anterior cingulate‚ÜĎ |
| Flanagan et al. (2019a) [A13] | Left and right amygdala responses (reactivity) |
OT, PBO: Right amygdala reactivity‚ÜĎ HC OT: Left amygdala reactivity‚ÜĎ |
| Koch et al. (2019) [A15] | Emotional processing areas (i.e., amygdala and insula), emotional control areas (i.e., thalamus, hippocampus, caudate nucleus, anterior cingulate cortex and medial prefrontal cortex) |
OT: Amygdala-left thalamus‚ÜĎleft thalamus reactivity‚ÜĎ PBO (F): Right amygdala down-regulation‚ÜĎ OT (F): Right amygdala down-regulation (-) |
1) žā¨ŪöĆ ŪĖČŽŹô žßÄŪĎú ŽįŹ žÉĚŽ¨ľŪĎúžßÄžěź žßÄŪĎú Í≤įÍ≥ľ
2) žč†Í≤Ĺ žėĀžÉĀ žßÄŪĎú Í≤įÍ≥ľ(fMRI)
4. Ž¨łŪóĆžĚė ŪŹČÍįÄ
Table 4.
| Random sequence generation | Allocation concealment | Blinding of participants and personnel | Blinding of outcome assessment | Incomplete outcome data | Selective outcome reporting | Other sources of bias | |
|---|---|---|---|---|---|---|---|
|
|
|||||||
| Single administration | |||||||
| Pitman et al. (1993) [A1] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Eidelman et al. (2015) [A2] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | High |
| Palgi et al. (2016) [A3] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Frijling et al. (2016a) [A4] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Frijling et al. (2016b) [A5] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Koch et al. (2016a) [A6] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Koch et al. (2016b) [A7] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Nawijn et al. (2016) [A8] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Palgi et al. (2017) [A9] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Sack et al. (2017) [A10] | Low | Low | Low | Low | Low | Uncertain | Low |
| Nawijn et al. (2017) [A11] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Flanagan et al. (2018a) [A12] | Uncertain | Uncertain | Low | Low | Low | Uncertain | Low |
| Flanagan et al. (2019a) [A13] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Flanagan et al. (2019b) [A14] | Low | Low | Low | Low | Low | Uncertain | Low |
| Koch et al. (2019) [A15] | Uncertain | Uncertain | Low | Uncertain (Low) | Low | Uncertain | Low |
| Stauffer et al. (2019) [A16] | Low | Low | Low | Low | Low | Uncertain | Low |
| Morrison et al. (2020) [A17] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Multiple administration | |||||||
| Zuiden et al. (2017) [A18] | Low | Low | Low | Low | Low | Uncertain | Low |
| Flanagan et al. (2018b) [A19] | Uncertain | Uncertain | Low | Low | Low | Uncertain | Low |
| Engel et al. (2020) [A20] | Uncertain | Uncertain | Low | Uncertain | Low | Uncertain | Low |
| Flanagan et al. (2020) [A21] | Low | Low | Low | Low | Low | Uncertain | Low |
| Sippel et al. (2020) [A22] | Uncertain | Uncertain | Low | Low | Low | Uncertain | Low |



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print